Anivel mundial, la situación de salud bucal es alarmante, enfermedades como la caries, la gingivitis, la periodontitis y la falta de piezas dentales son considerados problemas importantes de salud pública y privado, a pesar de ser prevenibles. Estas patologías bucodentales son graves y debilitantes, se manifiestan en experiencias de dolor, incapacidad de comer, comunicación limitada y baja autoestima debido a la pérdida de la función y de la estética del sistema estomatognático; ocasionando un impacto negativo sobre la salud general y la calidad de vida de quienes las padecen1. Al año 2021, la OMS estimó poco más de 3500 millones de casos de afecciones bucodentales en el mundo, siendo más extensivas que los trastornos mentales, las cardiopatías, la diabetes y el cáncer2.
Entre las patologías bucales, la enfermedad periodontal es la segunda causa de malestar oral después de la caries dental, tiene una prevalencia del 19 % a escala mundial y con mayor ocurrencia en población en edad productiva. En México, la tasa prevalente es del 50 % de la población entre los 35 y 79 años de edad. Esto representó, en el 2019, una carga económica entre los 11 y 50 dólares estadounidenses per cápita. Los casos imperan en regiones con limitado acceso a los servicios públicos de salud, educación, programas sociales y con ingreso económico medio2,3.
La enfermedad periodontal es una afección inflamatoria crónica que se caracteriza por una destrucción progresiva de los tejidos que rodean y soportan los dientes, incluyendo las encías, el hueso alveolar y los ligamentos periodontales, conduciendo a la pérdida de dientes si no se trata adecuadamente. Entre ellas se encuentra la gingivitis y la periodontitis. Como factor etiológico primario se reporta la formación de placa dental microbiana, la cual con la participación de factores adicionales de origen local, inmunológico y sistémico ocasionan la contaminación, inflamación y destrucción del periodonto1,4,5.
Con frecuencia, el agente causal ha sido catalogado de origen bacteriano. Sin embargo, la elevada incidencia de protozoos como Entamoeba gingivalis y Trichomonas tenax en las afecciones, ha llevado a algunos investigadores a considerarlos agentes etiológicos de la enfermedad, puntualizando que el aumento de la incidencia de estos protozoarios constituye un indicador de progresión de enfermedad periodontal6-8.
T. tenax es un protozoo comensal flagelado que habita en la cavidad de los dientes cariados, entre el sarro y en los márgenes gingivales de las encías de personas con pobre higiene bucal. Se transmite por contacto directo, gotas de saliva y fómites contaminados. Cuando se haya fuera de los límites de la cavidad bucal, puede ocasionar sinusitis, tonsilitis y tricomoniasis pulmonar9,10. Su patogenicidad ha sido relacionada a la presencia de proteínas de adhesión tisular y de actividad proteolítica similares a las de T. vaginalis11,12.
Aunque las infecciones por Tricomonas son generalmente tratadas con metronidazol, reportes de sabor metálico, resistencia adquirida, y mutagenicidad han sido informados, lo que finalmente expone la necesidad de nuevas terapias para tratar las tricomoniasis13.
En ese sentido, diversos productos naturales derivados de plantas etnomedicinales han desempeñado un rol importante en el control de enfermedades causadas por protozoarios que afectan la salud humana14,15. Sin embargo, el estudio de plantas medicinales, disponibles localmente, para atender infecciones por T. tenax, es aún limitado. En relación con esto, las especies vegetales Cordia dodecandra, Gaultheria odorata, Tagetes nelsonii y Talisia oliviformis, son utilizadas por la población indígena mexicana para el tratamiento de problemas gastrointestinales causados por bacterias y/o parásitos16,17 como se observa en la Figura 1. Previamente, nuestro grupo de trabajo demostró que los extractos orgánicos presentan actividad antimicrobiana18. Por ello, con la finalidad de establecer su uso integral en terapias para mantener la salud bucal, este trabajo tiene como objetivo determinar in vitro la actividad anti-Trichomonas tenax de C. dodecandra, G. odorata, T. nelsonii y T. oliviformis.

MATERIAL Y MÉTODOS
Químicos
El dimetilsulfóxido (DMSO 99.5 % para cultivo celular) y metronidazol (grado estándar analítico) fueron adquiridos en Sigma-Aldrich Corp. (St. Louis, MO, USA). Los productos químicos empleados en la preparación del medio TYI-S-33 (Ácido ascórbico, Citrato férrico amoniaco, Cisteína, Cloruro de sodio, Extracto de levadura y Glucosa de Sigma Aldrich; Fosfato monoácido de potasio y Fosfato diácido de potasio de JT Baker y Peptona de caseína de DIBICO) y los empleados en el proceso de extracción (n-hexano y Alcohol metílico de JT Baker) fueron de grado analítico obtenidos de la marca Fisher Scientific Chemical.
Obtención de plantas y preparación de extractos crudos
Las plantas fueron colectadas durante el invierno del 2021, en Tuxtla Gutiérrez (C. dodecandra en 16° 43´ 46.2´´ N, 93° 06´ 0.87´´ E y T. oliviformis en 16° 43´ 45.7´´ N, 93° 06´ 0.70´´ E) y Zinancatán (G. odorata y T. nelsonii en 16° 45´ 34.0´´ N, 92° 43´ 18.0´´ E), Chiapas, México. Los especímenes fueron identificados a nivel especie por personal profesional del herbario de la FCB-UANL, quedando registrados como: C. dodecandra (025879), T. oliviformis (025881), T. nelsonii (025883) y G. odorata (025884). El material vegetal se limpió, cortó, secó a temperatura ambiente sin iluminación directa y se trituró, empleando un molino de mano. Extractos hexánicos y metanólicos se obtuvieron mediante maceración mezclando 50g de material vegetal y solvente en una relación 1:10 durante 18 días a temperatura ambiente y sin agitación, realizando procesos de extracción cada seis días con hexano y aplicando sonicación por 15 minutos, seguido por extracción con metanol en las mismas condiciones. En cada ocasión, los extractos se filtraron y concentraron a presión reducida empleando un rotavapor Yamato Model RE2000. Finalmente, se secaron en una estufa a 40°C hasta alcanzar un peso constante para calcular el porcentaje de rendimiento. Los extractos obtenidos se almacenaron a 4°C hasta su utilización.
Cultivo de T. tenax
Trofozoítos de T. tenax cepa ATCC-30207 fueron cultivados en medio TYI-S-33 suplementado con suero bovino hasta una concentración de 10 % v/v. El cultivo se mantuvo bajo condiciones axénicas. Para los bioensayos de actividad antiprotozoaria se emplearon trofozoítos en su fase exponencial.
Actividad antiprotozoaria
De manera in vitro se realizaron una serie de bioensayos para determinar la actividad antiprotozoaria de los extractos crudos19. Brevemente, un inóculo de 1x105 trofozoítos de T. tenax/mL se incubó a 37 °C por 24 h en medio TYI-S-33 suplementado con suero bovino y en presencia de diferentes concentraciones (18.75 a 500 μg/mL) de los extractos crudos y metronidazol (0.015 a 0.25 μg/mL) como control positivo. En resumen, 30 mg de cada extracto y 10 mg de metronidazol se disolvieron primero de forma independiente en 250 µL de DMSO y se diluyeron con agua desionizada estéril y medio inoculado hasta alcanzar la concentración deseada. La concentración final de DMSO no superó el 0.25 % v/v en las diluciones ensayadas. Cada ensayo contó con un blanco (medio inoculado).
Se realizaron dos ensayos independientes por triplicado. En cada ensayo se evaluaron los extractos, metronidazol, DMSO (a las concentraciones establecidas) y un blanco (medio inoculado). Tras la incubación, se preparó una dilución 1:10 de cada ensayo con formalina. Se contó el número de parásitos con un hemocitómetro, se determinó el % de inhibición con respecto al tubo blanco.
Análisis estadístico
La concentración que inhibe el crecimiento del trofozoíto en un 50 % (CI50) se determinó mediante regresión lineal Probit, como se observa en la Figura 2. Además, los datos se sometieron a un análisis de varianza bifactorial y se aplicó la prueba Tukey para determinar la diferencia estadística entre tratamientos, utilizando SPSS Statistics Versión 18.0 (IBM SPSS Statistics for Windows, Armonk, NY).
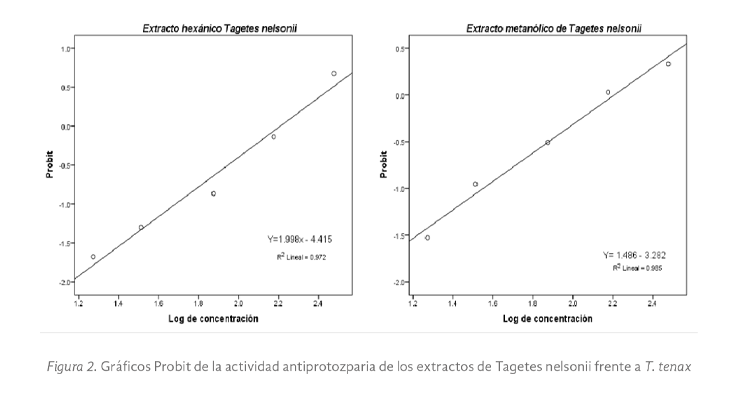
Resultados
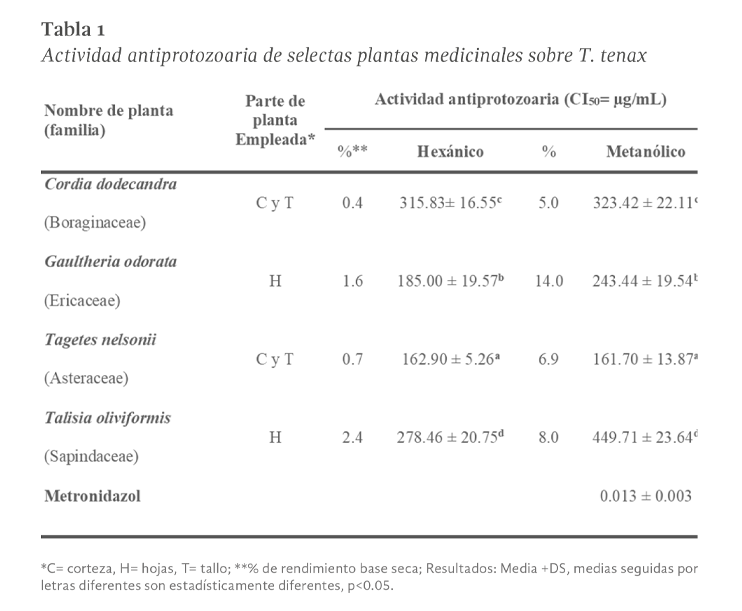
Un total de ocho extractos crudos, cuatro metanólicos, cuatro hexánicos y metronidazol, fueron evaluados frente a trofozoítos de T. tenax. El rendimiento de extracción y la actividad antiprotozoaria in vitro (CI50) de los extractos obtenidos de las cuatro plantas medicinales evaluadas se muestran en la Tabla 1. Los resultados muestran un mayor rendimiento de extracción al emplear metanol como solvente con rendimientos entre el 5,0 % para C. dodecandra y el 14 % para G. odorata. El análisis estadístico reveló efectos significativos tanto del tipo de planta (F= 151.54, p < 0.05), del tipo de extracto (F= 61.08, p < 0.05), como de su interacción (F= 27.57, p < 0.05) sobre la actividad antiprotozoaria. La comparación múltiple mediante la prueba de Tukey mostró diferencia significativa (p < 0.05) entre las plantas evaluadas. En particular, T. nelsonii presentó la mayor actividad anti-T. tenax, significativamente superior al resto de las especies, mientras que T. oliviformis mostró la menor actividad. Los resultados sugieren que tanto la especie vegetal como el tipo de extracto influyen de manera importante en la actividad antiprotozoaria, y que existe una interacción específica entre ambos factores.
Discusión
En el presente trabajo se demostró la actividad antiprotozoaria de los extractos de selectas plantas de la etnomedicina mexicana frente a T. tenax. Es importante mencionar que la investigación de plantas medicinales para tratar las infecciones por T. tenax es casi inexistente. Sin embargo, se ha reportado actividad anti-Trichomonas de Origanum mejorana sobre Pentatrichomonas hominis, protozoario comensal humano causante de tricomoniasis intestinal20, así como de Carica papaya, Cocus nucifera y Persea americana frente a Trichomonas vaginalis, agente causal de tricomoniasis vaginal humana21,22.
En cuanto a T. tenax, se ha reportado actividad anti-Trichomona del extracto etanólico de Punica granatum con una concentración efectiva de 12.5 μg/mL23. Asimismo, la actividad antiperiodontitis de Punica granatum ha sido confirmada24. El estudio in vivo de la infusión de Eugenia cariophylla sobre T. tenax ha sido informado efectivo a concentración de 300 mg/mL25.
Por otro lado, se ha comunicado la actividad antigingivitis de Aloe vera, Camellia sinensis, Punica granatum y Salvadora pérsica incorporados a dentífricos con una notable reducción de la enfermedad periodontal26.
Lo anterior señala la relevancia de los resultados obtenidos en esta investigación, ya que las cuatro plantas evaluadas mostraron efecto anti-T.tenax, siendo interesante la actividad mostrada por T. nelsonii y G. odorata, cuya propiedad biológica podría extenderse hacia la búsqueda sistemática de los metabolitos tricomonicidas a través de un fraccionamiento biodirigido que resulte en el incremento de la actividad antiprotozoaria y su posterior empleo en el desarrollo de dentífricos, antisépticos bucales y colutorios para el cuidado de la salud bucodental.
En relación con esto, se destaca el potencial de la planta Tagetes, investigaciones señalan a este género albergar especies que exhiben actividad insecticida, acaricida antimicrobiana, antimicótica y antihelmíntica, atribuidas a la presencia de terpenos como: alilenasol, β-cariofileno, trans-anetol y tagetona27-29. Además, se ha determinado en el aceite esencial de T. nelsonii a la cis-tagetenona, β-tagetona y dihidrotagetona como principales compuestos mayoritarios y, en menor proporción, la ocurrencia de α-terpineol, trans-β-ocimeno, limoneno, α-pineno, mirceno, mesitileno, α-terpineno, eucaliptol, linalol y β-copaeno30. Eugenol, carvacrol, mentol y timol han sido encontrados en los aceites esenciales y extractos orgánicos de Tagetes, su actividad antiprotozoaria podría estar relacionada a cambios en la permeabilidad de la membrana celular31. Por otro lado, se ha documentado la presencia de ácido gallico, ácido quínico, ácido siríngico, ácido elágico, quercetina, kaempferol, patuletina, isorhamnetina, axillarin y sus derivados glucósidos en los extractos metanólicos de T. erecta, compuestos con potente actividad quelante de iones Fe+2, un cofactor esencial de proteínas Fe-S, participes en el metabolismo energético de tricomonas.32, 33 Sesquiterpenos, esteroles, triterpenos y tetraterpenos han sido aislados de las hojas de miembros de la familia Asteraceae y se ha notificado que previenen la progresión del crecimiento de Leishmania amazonensis, Plasmodium falciparum y Trypanosoma brucei posiblemente por alteración de la actividad mitocondrial34, quizá un efecto similar ocurra en los hidrogenosomas de T. tenax de encontrarse este tipo de metabolitos en el extracto hexánico.
Con respecto a C. dodecandra, se ha evidenciado la ocurrencia de fenilpropanoides como el ácido rosmarínico, la siringina y el ácido salvialónico B; flavonoides derivados de la quercetina y alcaloides como la alantoína en extractos35. Es posible que la actividad anti-T. tenax exhibida por los extractos de T. nelsonii y C. dodecandra en este trabajo se deba a uno metabolito en particular o a la actividad sinérgica de los mismos. Concerniente a G. odorata y T. oliviformis la composición química de sus extractos es aún desconocida.
Conclusión
Considerando el origen multimicrobiano e impacto sanitario y económico de las enfermedades periodontales en la salud humana, es necesario disponer de nuevas estrategias y coadyuvantes para mantener la salud bucodental. En ese sentido, el presente trabajo incrementa el acervo científico de productos naturales con actividad anti-T. tenax mostrando a T. nelsonii con el mejor efecto tricomonicida y como candidato para la búsqueda de posibles compuestos con actividad antiprotozoaria. Además, los resultados obtenidos enriquecen el conocimiento ancestral de los recursos herbarios de la etnomedicina mexicana para el tratamiento de infecciones por parásitos y enfermedades de la cavidad bucal.
Referencias
- Pardo, RFF y Hernández, LJ. (2018). Enfermedad periodontal: enfoques epidemiológicos para su análisis como problema de salud pública. Revista de Salud Pública 20 (2), 258-264.
- Organización Mundial de la Salud [OMS]. (2022). Informe sobre la situación mundial de la salud bucodental: Hacia la cobertura sanitaria universal para la salud bucodental de aquí a 2030. Resumen ejecutivo. Ginebra.
- Marín, J. R. y Duque, D. A. (2021). Condiciones modificadoras del riesgo de enfermedad periodontal: Una revisión narrativa sobre la evidencia en América Latina. CES Odontología, 34(1), 82–99.
- Rojas, I. M. V., Rivero, A. D., Fernández, Y. D., Cabrera, B. A. S. y Alonso, Y. T. (2018). Prevalence and severity of the periodontal illness diabetic patients. Revista Médica Electrónica, 40(6), 1911–1930.
- Sid, P. J. M., Castillo, B. R., Martínez, A. V. M., Rivas, G. F. J., Rodríguez, S. E., y Hoyos, P. R. (2018). Prevalencia de enfermedad gingival en pacientes adultos de una comunidad rural con diabetes mellitus tipo dos en Catmís, Tzucacab, Yucatán. Revista Odontológica Latinoamericana, 10(2), 33–37.
- Acurero, O. E. M., Maldonado, I. A. B., Maldonado, I. C., Bracho, M. A. M., Parra, J. U. Y., y Urdaneta, M. (2009). Entamoeba gingivalis y Trichomonas tenax en cavidad bucal de pacientes de la Clínica Integral del Adulto de la Facultad de Odontología, Maracaibo, Venezuela. Revista de la Sociedad Venezolana de Microbiología, 29(2), 122–127.
- Bisson, C., Dridi, S. M., y Machouart, M. (2019). Assessment of the role of Trichomonas tenax in the etiopathogenesis of human periodontitis: A systematic review. PLOS ONE, 14(12), e0226266. https://doi.org/10.1371/journal.pone.0226266
- Alves, J., dos Santos, M., Soares, I., Riscalar, R., Moura, C., y Costa da Cunha Oliveira, C. (2020). Detection of oral Entamoeba gingivalis and Trichomonas tenax in adult quilombola population with periodontal disease. ODOVTOS-International Journal of Dental Sciences, 22(2), 157–164. https://doi.org/10.15517/ijds.v22i2.41894
- Arspag, O. F., y Kaya, O. M. (2020). Presence of Trichomonas tenax and Entamoeba gingivalis in peri-implantitis lesions. Quintessence International, 51(3), 212–218. https://doi.org/10.3290/j.qi.a43762
- Oladokun, A. O., Opeodu, O. I., Lawal, A. O., y Falade, M. O. (2021). Entamoeba gingivalis and Trichomonas tenax in periodontal disease. Microbiology Research Journal International, 31(3), 61–72. https://doi.org/10.9734/mrji/2021/v31i330307
- Marty, M., Lemaitre, M., Kémoun, P., Morrier, J. J., y Monsarrat, P. (2017). Trichomonas tenax and periodontal diseases: A concise review. Parasitology, 144(11), 1417–1425. https://doi.org/10.1017/S003118201700118X
- Matthew, M. A., Yang, N., Ketzis, J., Mukaratirwa, S., y Yao, C. (2023). Trichomonas tenax: A neglected protozoan infection in the oral cavities of humans and dogs—a scoping review. Tropical Medicine and Infectious Disease, 8(60), 1–15. https://doi.org/10.3390/tropicalmed8010060
- Selim, M. A., Fawzy, E. M., Abd, E. E. M., Abdel, H. R. S., Badr, M. S., y Abdel, H. E. F. (2020). Evaluation of the effect of some medicinal plants on cultured Trichomonas vaginalis. Journal of Infection in Developing Countries, 14(7), 793–799. https://doi.org/10.3855/jidc.12676
- Ramírez, M. E., Mendoza, J. A., Arreola, R. H., y Ordaz, P. C. (2010). Flavonoides con actividad antiprotozoaria. Revista Mexicana de Ciencias Farmacéuticas, 41(1), 6–21.
- Castaño, J. C., y Giraldo, A. M. (2019). Antiparasitic phytotherapy perspectives, scope, and current development. Infectio, 23(2), 189–204. https://doi.org/10.22354/infectio.v23i2.679
- De la Cruz, J. L., Guzmán, L. M., y Viveros, V. E. (2014). Traditional medicinal plants used for the treatment of gastrointestinal diseases in Chiapas, México. World Applied Sciences Journal, 31, 508–515. https://doi.org/10.5829/idosi.wasj.2014.31.03.825
- Orontes, G. C., Moreno, M. R., Caballero, R. A., y Farrara, S. O. (2018). Plantas utilizadas en la medicina tradicional de comunidades campesinas e indígenas de la Selva Zoque, Chiapas, México. Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas, 17(5), 503–521. https://doi.org/10.37360/blacpma.2018.17.5.503
- De la Cruz, J. L., Hernández, T. M. A., Monroy, G. I. N., Rivas, M. C., Verde, S. M. J., González, V. V., y Viveros, V. E. (2022). Biological activities of seven medicinal plants used in Chiapas, Mexico. Plants, 11(14), 1790. https://doi.org/10.3390/plants11141790
- Mata, C. B. D., Vargas, V. J., González, S. F., Palacios, C. R., y Salvador, S. F. (2008). A new vial microassay to screen antiprotozoal drugs. Pharmacologyonline, 1, 529–537.
- Kozłowska, M., Laudy, A., Starościak, B. J., Napiorkowski, A., Chomicz, L., y Kazimierczuk, Z. (2010). Antimicrobial and antiprotozoal effect of sweet marjoram (Origanum majorana L.). Acta Scientiarum Polonorum. Hortorum Cultus, 9, 133–141.
- Calzada, F., Yépez, L., y Tapia, A. (2007). Effect of Mexican medicinal plant used to treat trichomoniasis on Trichomonas vaginalis trophozoites. Journal of Ethnopharmacology, 113(2), 248–251. https://doi.org/10.1016/j.jep.2007.05.021
- Jiménez, A. A., Luna, H. J., Ruiz, N. R., Cornejo, G. J., Tapia, A., y Yépez, M. L. (2013). Antiprotozoal and antimycobacterial activities of Persea americana seeds. BMC Complementary and Alternative Medicine, 13, 109. https://doi.org/10.1186/1472-6882-13-109
- El-Sherbini, G., y Shoukry, N. M. (2012). In vitro effect of pomegranate peel extract on Trichomonas tenax. Life Science Journal, 9, 791–797.
- Páez, V. M., Mill, F. E., Gutiérrez, F. R., y Vizcaya, S. M. (2021). Enjuague bucal de Punica granatum como coadyuvante en el tratamiento de la periodontitis. Revista Científica Especialidades Odontológicas UG, 4(2), 7–14.
- Shlash, S., y Kadhum, H. (2020). A vital role of aqueous extract of the plant Eugenia caryophyllata (clove) in treated Trichomonas tenax infection for patients attended dental clinics, Kufa University. Indian Journal of Public Health Research & Development, 10.
- Safiaghdam, H., Oveissi, V., Bahramsoltani, R., Farzaei, M. H., y Rahimi, R. (2018). Medicinal plants for gingivitis: A review of clinical trials. Iranian Journal of Basic Medical Sciences, 21(10), 978–991.
- Ball, C. B., Bruin, A. J., Roy, R. C., y Riga, E. (2003). Forage pearl millet and marigold as rotation crops for biological control of root-lesion nematodes in potato. Agronomy Journal, 95(2), 282–292. https://doi.org/10.2134/agronj2003.2820
- Eguaras, M. J., Fuselli, S., Gende, L., Fritz, R., Ruffinengo, S. R., Clemente, G., Gonzalez, A., Bailac, P., y Ponzi, M. I. (2005). An in vitro evaluation of Tagetes minuta essential oil for the control of the honeybee pathogens Paenibacillus larvae and Ascosphaera apis, and the parasitic mite Varroa destructor. Journal of Essential Oil Research, 17(3), 336–340. https://doi.org/10.1080/10412905.2005.9698899
- Segovia, K., Suárez, L., Castro, A. J., Suárez, S., y Ruiz, Q. (2010). Composición química del aceite esencial de Tagetes elliptica Smith “chincho” y actividades antioxidante, antibacteriana y antifúngica. Ciencia e Investigación, 13, 81–86.
- Cruz, F. O., Espinoza, R. M., Santiesteban, H. A., y Cruz, L. L. (2021). Caracterización química de los volátiles de Tagetes nelsonii. Polibotánica, 51, 203–211.
- Salehi, B., Valussi, M., Morais-Braga, M. F. B., Carneiro, J. N. P., Leal, A. L. A. B., Coutinho, H. D. M., Vitalini, S., Kręgiel, D., Antolak, H., Sharifi-Rad, M., Silva, N. C. C., Yousaf, Z., Martorell, M., Iriti, M., Carradori, S., & Sharifi-Rad, J. (2018). Tagetes spp. essential oils and other extracts: Chemical characterization and biological activity. Molecules, 23(11), 2847. https://doi.org/10.3390/molecules23112847
- Kumar, P. S., y Luyten, W. (2018). Antiparasitic activity in Asteraceae with special attention to ethnobotanical use by the tribes of Odisha, India. Parasite, 25, 10. https://doi.org/10.1051/parasite/2018009
- Burlec, A. F., Pecio, Ł., Kozachok, S., Mircea, C., Corciovă, A., Vereștiuc, L., Cioancă, O., Oleszek, W., y Hăncianu, M. (2021). Phytochemical profile, antioxidant activity, and cytotoxicity assessment of Tagetes erecta L. flowers. Molecules, 26(5), 1201. https://doi.org/10.3390/molecules26051201
- Sehgal, R., Goyal, K., y Sehgal, A. (2012). Trichomoniasis and lactoferrin: Future prospects. Infectious Diseases in Obstetrics and Gynecology, 536037. https://doi.org/10.1155/2012/536037
- Aguilar, V. R., y Quijano, L. (2016). Compuestos químicos del extracto metanólico en tallos de Cordia dodecandra. Revista Latinoamericana de Química, 44(9).
 https://orcid.org/0000-0002-2017-9605
https://orcid.org/0000-0002-2017-9605
 https://orcid.org/0000-0003-4532-2604
https://orcid.org/0000-0003-4532-2604
 https://orcid.org/0000-0001-8800-1443
https://orcid.org/0000-0001-8800-1443
 https://orcid.org/0000-0001-5944-7972
https://orcid.org/0000-0001-5944-7972



